MSCs-Exo系列二 | 间充质干细胞外泌体在伤口愈合和皮肤再生中的应用
间充质干细胞(MSCs)是一种来自于中胚层的多能干细胞,具有高度的自我更 新及多向分化潜能,并在适宜的条件下具有诱导分化为肌细胞、软骨细胞、成骨细胞、成脂细胞 等多种细胞的能力。
MSCs 不仅具有多向分化潜能,而且还具有免疫调节功能,可抑制多种免 疫细胞的性能,调节免疫应答。
近年来,研究发现,来源于 MSCs 的外泌体(MSCs-Exo)具有与 MSCs 相似的组织损伤修复和再生功能。外泌体(exosome)是多种细胞分泌的膜外小囊泡,直 径 30 ~ 200 nm,可以转运核酸、脂质和蛋白质,参与细胞间的信息交流。
与 MSCs 相比,外泌体 用于临床疾病的治疗更加稳定,体内同种异体给药后免疫排斥反应的可能性较低,并可为各种 疾病提供替代疗法。MSCs-Exo 逐渐成为新的研究热点。
间充质干细胞外泌体的临床应用系列:
MSCs-Exo系列一 | 间充质干细胞外泌体在免疫调节中的作用
MSCs-Exo系列二 | 间充质干细胞外泌体在伤口愈合和皮肤再生中的应用
MSCs-Exo系列三 | 间充质干细胞外泌体在神经损伤中的应用
MSCs-Exo系列四 | 间充质干细胞外泌体在肝损伤中的应用
MSCs-Exo系列五 | 间充质干细胞外泌体在肾损伤中的应用
MSCs-Exo系列六 | 间充质干细胞外泌体在脑卒中治疗中的应用
MSCs-Exo系列七 | 间充质干细胞外泌体在糖尿病治疗中的应用
本期:MSCs-Exo系列二|间充质干细胞外泌体在伤口愈合和皮肤再生中的应用
1.外泌体促进细胞自我修复和组织再生
遵义医科大学附属医院烧伤整形科和意大利维罗纳大学医学院的研究团队在科技期刊 Burns Trauma. 上发表题为Corrigendum to: 'Mesenchymal stromal cells-exosomes: a promising cell-free therapeutic tool for wound healing and cutaneous regeneration'(间充质干细胞-外泌体:伤口愈合和皮肤再生的有前途的无细胞治疗工具)的研究报告
该报告指出,间充质干细胞(MSCs)参与皮肤伤口愈合的整个过程,而外泌体是MSCs释放的关键因子之一,具有MSCs相似的功能,可以调节受体细胞的活性,促进细胞自我修复和组织再生,加速损伤部位的伤口修复。

2.外泌体发挥抗炎作用
研究表明,MSCs-Exo 可以促进受体巨噬细胞向抗炎 M2 型转变,此外,还能调节 B 淋巴细胞的活化、分化和增殖,并能抑制T淋巴细胞的增殖。
MSCs-Exo 还可将活化的T淋巴细胞转化为调节性T细胞,从而发挥免疫促进作用。
细胞外囊泡的抗炎作用完全由CD147所介导
德国马克斯-普朗克研究所的科研团队在科技期刊 J Med Chem.上发表的Anti-inflammatory effects of extracellular cyclosporins are exclusively mediated by CD147的研究指出,细胞外囊泡的抗炎作用完全由CD147所介导。

该研究指出,白细胞贩运和招募是宿主免疫监视和炎症性疾病中的一个关键过程。
细胞外嗜环蛋白(eCyps)已被确定为一类新的趋化介质。
使用一种结构简化的细胞可渗透的eCyp抑制剂,分析了eCyp/CD147相互作用对炎症期间白细胞招募的影响。
这种化合物在体外高度有效地抑制白细胞向CypA迁移,以及在实验诱导的腹膜炎和迟发性超敏反应的小鼠模型的炎症期间招募白细胞。
通过使用CD147-/-小鼠和可渗透的eCyp抑制剂,研究人员能够证明eCyps在炎症中的作用完全由与CD147的相互作用介导。
研究结果表明,阻断eCyps可能是一个有效的治疗目标,以减少与白细胞招募有关的炎症性疾病。
抑制受刺激T细胞的炎症反应
西班牙巴塞罗那再生医学中心的科研团队2017年在学术期刊 Theranostics上发表了标题为Nanosized UCMSC-derived extracellular vesicles but not conditioned medium exclusively inhibit the inflammatory response of stimulated T cells: implications for nanomedicine(纳米化UCMSC衍生的细胞外囊泡而不是条件培养基能完全抑制受刺激T细胞的炎症反应:对纳米医学的影响)的研究报告。

该报告指出,不良的免疫反应极大地阻碍了异体器官移植和细胞治疗后的效果,也导致了炎症性疾病和自身免疫。
脐带间充质干细胞(UCMSCs)具有强大的再生和免疫调节潜力,它们分泌的细胞外囊泡(EVs)被认为是一种有希望的天然纳米粒子来源,以提高器官移植的效果和控制炎症性疾病。
研究证实细胞外囊泡(EVs)是MSC旁分泌免疫抑制功能的一个积极组成部分,并肯定了其在纳米医学中的治疗潜力。
此外,研究结果强调,要达到免疫抑制的效果,必须对间充质干细胞衍生的EVs进行良好的纯化和制备。
3.外泌体修复视网膜损伤,抑制炎症反应
研究发现,在许多疾病模型中,MSCs- Exo 可以促进抗炎细胞因子的上调(如:IL-10),而据报道,IL-10 在调节皮肤伤口炎症和瘢痕形成中起着至关重要的作用。
天津医科大学眼科医院和美国肯塔基大学路易斯维尔分校肯塔基狮子眼科中心的科研团队在Sci Rep.上发表了题为Exosomes derived from MSCs ameliorate retinal laser injury partially by inhibition of MCP-1(来自间充质干细胞的外泌体通过抑制MCP-1改善视网膜激光损伤)的研究报告。

该报告指出,尽管积累的证据支持间充质干细胞(MSCs)以旁分泌的方式行事,但其机制仍未被完全理解。
最近,间充质干细胞的外泌体(MSC-Exos),一种从间充质干细胞释放的微囊,被认为可以携带功能蛋白和RNA到受体细胞并发挥治疗作用。
在该研究中,研究人员通过玻璃体注射来自小鼠脂肪组织或人类脐带的间充质干细胞及其外泌体,观察和比较它们在激光诱导的视网膜损伤小鼠模型中的功能。
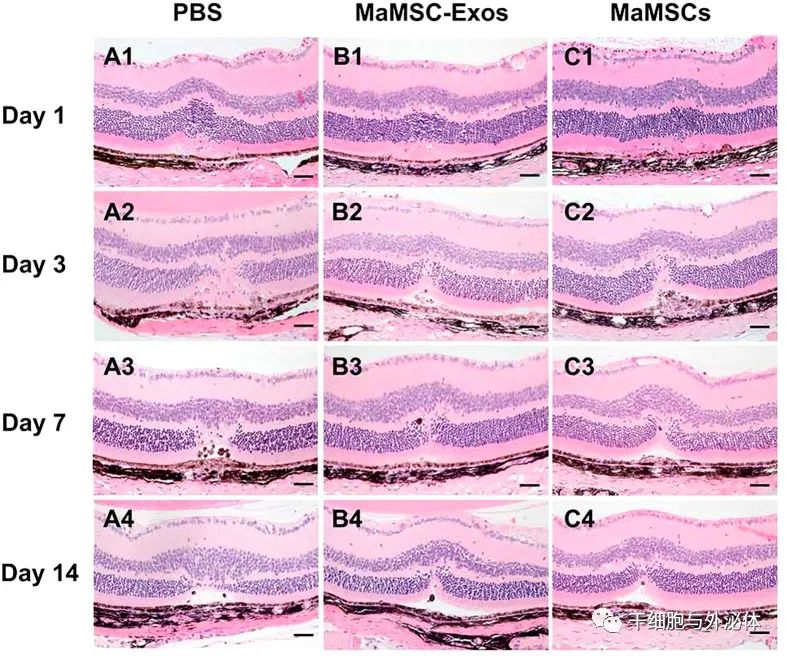
图. 不同时间点的H&E染色图像的代表例子。PBS(A1)、maMSC-Exo(B1)或maMSC(C1)治疗组伤后一天。PBS(A2)、maMSC-Exo(B2)或maMSC(C2)治疗组受伤后三天。PBS(A3)、maMSC-Exo(B3)或maMSC(C3)治疗组受伤后七天。PBS(A4)、maMSC-Exo(B4)或maMSC(C4)治疗组伤后14天。比例尺=50μm。
研究发现,间充质干细胞及其外泌体都能减少损伤,抑制细胞凋亡,并抑制炎症反应,在体内获得更好的视觉功能,程度几乎相同。注射MSC-Exos后发现视网膜中的单核细胞趋化蛋白(MCP)-1明显下调。
在体外,MSC-Exos也下调了热损伤后主要培养的视网膜细胞中的MCP-1 mRNA表达。
进一步证明,玻璃体内注射MCP-1中和抗体能促进视网膜激光损伤的恢复,而当MSC-Exos和MCP-1同时给药时,外泌体的治疗效果被取消。
总之,这些结果表明,MSC-Exos部分通过下调MCP-1来改善激光引起的视网膜损伤。
4.外泌体通过皮肤细胞的迁移和增殖来加速伤口愈合
德国科学家在Biochemical and Biophysical Research Communications上发表了题为Human fibrocyte-derived exosomes accelerate wound healing in genetically diabetic mice(人类纤维细胞衍生的外泌体加速了遗传性糖尿病小鼠的伤口愈合)的研究报告。

该研究发现 MSCs-Exo 可通过诱导糖尿病大鼠模型中皮肤细胞的迁移和增殖来加速伤口愈合。
该研究指出,糖尿病溃疡在全世界范围内代表着巨大的社会和医疗负担,对目前的治疗策略几乎没有反应。
研究结果表明,外泌体表现出体外促血管生成的特性,激活了糖尿病皮肤成纤维细胞,诱导了糖尿病角质细胞的迁移和增殖,并在体内加速了糖尿病小鼠的伤口闭合。
外泌体货物的重要成分是热休克蛋白-90α,总的和激活的信号转导器和转录激活器3,促血管生成(miR-126、miR-130a、miR-132)和抗炎(miR124a、miR-125b)微RNA,以及调节胶原蛋白沉积的微RNA(miR-21)。
这项概念验证研究证明了使用纤维细胞衍生的外泌体治疗糖尿病溃疡的可行性。
总之,各种研究表明,MSCs-Exo 还可通过特定的miRNAs发挥免疫调节作用,研究发现携带 miRNA-181c的脐带 MSCs- Exo通过下调Toll样受体 4 (TLR4)信号通路,减轻烧伤引起的强烈炎症反应。
综上研究表明,MSCs-Exo 在伤口愈合的整个阶 段发挥了重要的调节作用。基于此机制 MSCs-Exo 将有望用于临床免疫系统类疾病的治疗。
本文转载自“ 干细胞与外泌体微信公众号”如有侵权请联系本站删除。

