外泌体科普系列(二): 外泌体:极具潜力的纳米级药物递送系统
外泌体(exosomes)作为信号分子的天然载体,具有药物递送、疾病治疗的应用潜能。外泌体具有囊泡结构,其膜上和内部均可携带各种分子,并且通过融合、吞噬、或识别结合受体来将有效载荷(payloads)传递给目标细胞。研究表明,天然外泌体能够装载核酸(如mRNA、miRNA、siRNA、lncRNA和DNA)、蛋白质、代谢物等。以此为启发,人们着力于开发外泌体在疾病治疗上的潜力。
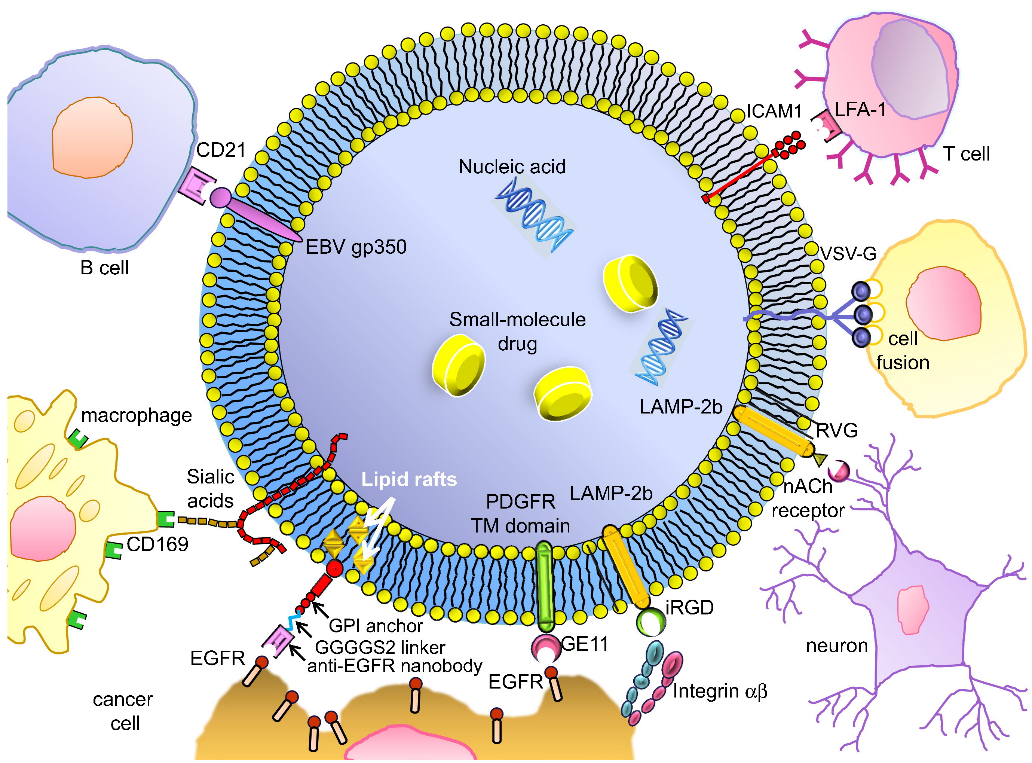
(Barile and Vassalli, 2017)
mRNA:
早在20世纪90年代,研究者就提出利用治疗性mRNA(therapeutic mRNAs)翻译产生蛋白质来进行疾病治疗。然而这种mRNA依赖的治疗(mRNA-based therapy)面临着两个重要的挑战。一是mRNA分子自身的不稳定性(instability);二是外源转录mRNA(in vitro-transcribed mRNA,IVT)的免疫原性(Immunogenicity)。为了降低mRNA的免疫原性,研究者使用人工合成的带修饰的核苷酸生成mRNA, 如m6A, Ψ, m1Ψ, 5mC, 5hmC,5moC,2FdU和2FdC 修饰等。在此基础上,用外泌体包裹mRNA作为给药载体,具有诸多优势。首先,mRNA被包裹在外泌体内,有效地避免了降解;然后,外泌体在体液中运输,利用其自身靶向特点识别目标细胞,使mRNA精准有效地呈递到目标细胞,并进一步发挥治疗功能。例如,外泌体负载mRNA呈递系统已经被用于治疗帕金森病(Parkinson’s disease)、乳腺癌(breast cancers)、白血病(leukemia)、胶质瘤(glioma)和神经鞘瘤(schwannoma)等。研究者设计了EXOtic系统(EXOsomal transfer into cells),在HEK-293T细胞中生产外泌体,并将catalase mRNA装载入外泌体,并运输到大脑,有效降低帕金森病中的神经炎症(neuroinflammation) (Kojima, Bojar et al. 2018)。另外,研究者使用EXO-DEPT体系运载HChrR6 mRNA靶向具有HER2受体的癌细胞,来治疗乳腺癌 (Forterre, Wang et al. 2020)。同时,利用装载Cas9 mRNA 和靶标mir-125b-2 位点gRNA的外泌体来治疗白血病(Usman, Pham et al. 2018);利用装载PTEN mRNA (phosphatase and tensin homolog)的外泌体来治疗胶质瘤(Yang, Shi et al. 2020);利用装载CD-UPRT mRNA的外泌体来治疗神经鞘瘤等。
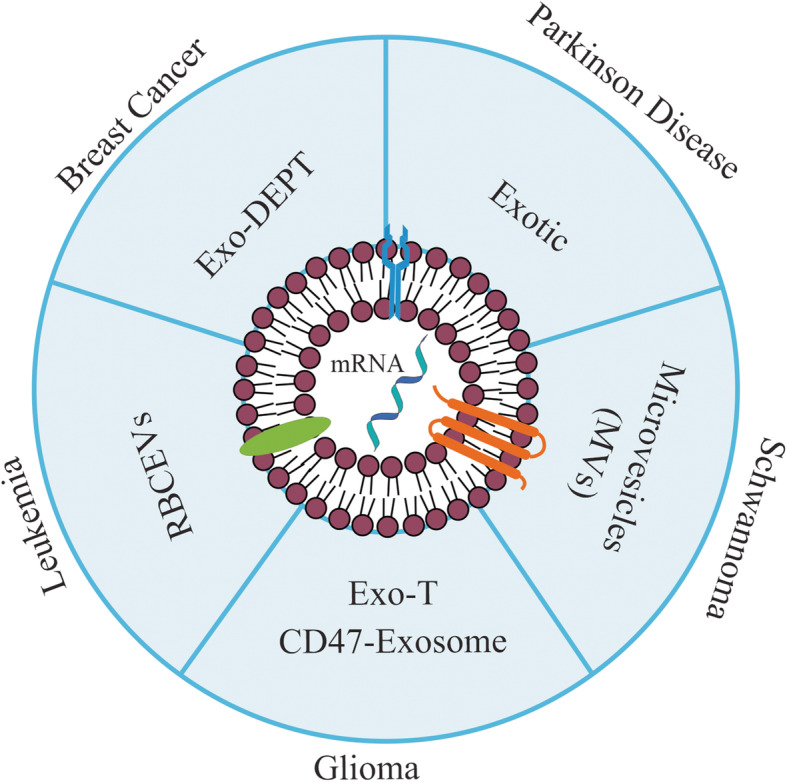
(Aslan, Kiaie et al. 2021)
miRNA和siRNA
RNAi是指由小RNA如siRNA或miRNA介导的基因沉默。近年来,RNAi治疗日益凸显其优势。首先,siRNA或miRNA通过碱基互补配对能够特异高效地结合靶标,对其进行沉默;另外,在实践过程中,siRNA或miRNA序列长度短,稳定性更高。在发展RNAi治疗的过程中,小RNA的运输一直是一个关键问题。小RNA是亲水性的带负电的分子,不能穿透细胞膜,并且易被RNase降解,因此需要高效安全的运输体系使其准确有效地进入目标细胞。外泌体作为载物平台具有良好的输送效率、膜渗透能力、非免疫原性及毒性,因此是高速发展的
小RNA递送平台。到目前为止,许多研究已经采用外泌体作为小RNA的载体来治疗各种疾病,特别是脑部疾病和肿瘤。外泌体能够穿越血脑屏障(blood-brain barrier,BBB),经常被用来作为小RNA运载平台来治疗神经系统疾病(Neurological disorders)。例如,通过RVG-exosome系统运输靶向BACE-1的siRNA ,降低BACE-1的表达,来治疗阿尔茨海默氏病(Alzheimer's disease)(Alvarez-Erviti, Seow et al. 2011);运输靶向MOR的siRNA,降低MOR的mRNA和蛋白质水平,治疗吗啡复吸(Morphine relapse) (Liu, Li et al. 2015);研究者利用从由间充质干细胞(mesenchymal stem cells)衍生的外泌体负载靶向KrasG12D的siRNA,治疗IV期胰腺癌患者(NCT03608631)(Kamerkar et al., 2017)。来源于骨髓基质细胞( marrow stromal cells,MSC)的外泌体携带 miR-146,通过抑制胶质瘤异种移植生长(Glioma xenograft growth), 治疗原发性脑瘤 (Katakowski, Buller et al. 2013)。另外,外泌体运载小RNA还被广泛用于治疗肿瘤(tumors),比如运载Let-7a miRNA,靶向HMGA2和RAS基因家族,抑制肿瘤生长 (Ohno et al., 2013);运载靶向TGF-β1的siRNA的外泌体,可以用来抑制肿瘤细胞的生长和转移(Zhang et al., 2014)。除此之外,外泌体运载的多种siRNA或miRNA也被广泛用在治疗眼部疾病、肾病和肝病等等。
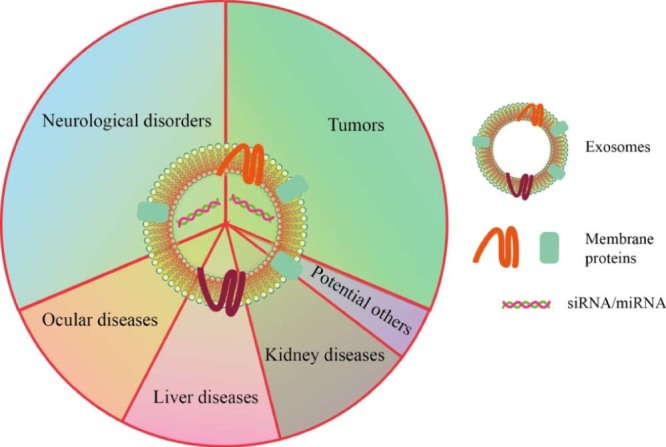
(Lu, Xing et al. 2018)
蛋白质
除了众多治疗性RNA外,治疗性蛋白质也能够被装载入外泌体中,用于疾病治疗,通常为以下四种方式。第一种,细胞质蛋白在外泌体自然形成的过程中被包裹装载;第二种,细胞质蛋白被包裹装载在人为设置尺寸的“人工外泌体”中;第三种,治疗性蛋白与外泌体膜蛋白融合,从而被装载;第四种,治疗性蛋白与细胞膜蛋白融合,并且加上寡聚信号(oligomerization signal)帮助装载入外泌体。如此,外泌体装载治疗性蛋白质具有稳定性好、特异性强的优势。例如,Schwannomas是由脱分化的Schwann细胞沿着周围神经生长出的良性肿瘤,压迫神经导致疼痛、虚弱、瘫痪或听力丧失。通过293T细胞,将胞嘧啶脱氨酶(cytosine deaminase,CD)和尿嘧啶核苷酸转移酶(uracil phosphoribosyltransferase,UPRT)装载入外泌体,通过抑制目标细胞DNA合成,从而有效杀死肿瘤细胞 (Mizrak et al., 2013)。另外,caspase-1 也被报道可以装载入外泌体,引起靶标细胞死亡,从而治疗肿瘤。外泌体装载蛋白作为疾病治疗手段正在迅猛发展,具有重大意义。
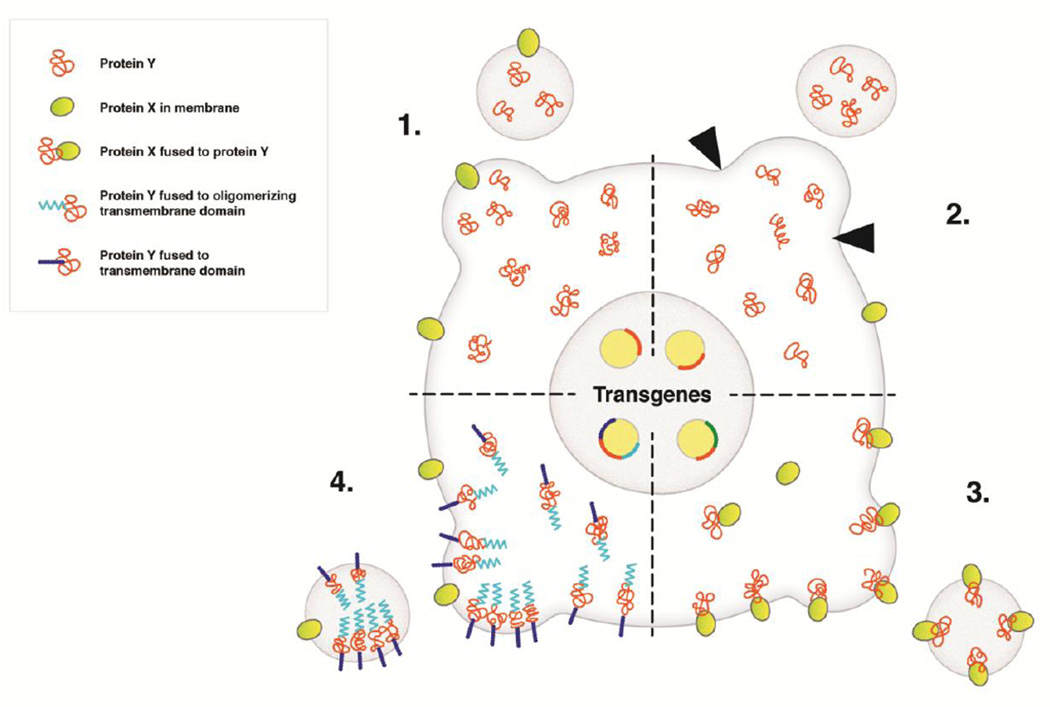
(Hall et al., 2016)
疫苗
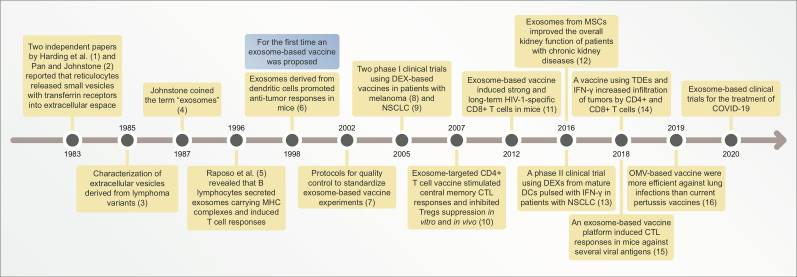
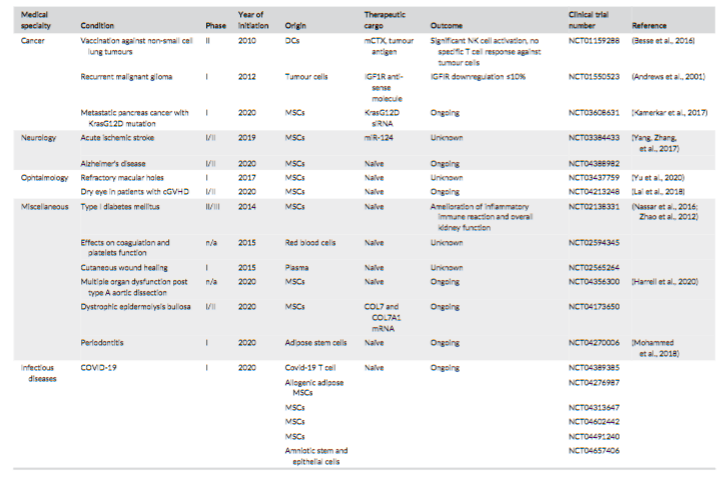
疫苗对人类的重要性不言而喻。疫苗是利用细菌、病毒、肿瘤细胞及代谢产物等制成的可使机体产生特异性免疫反应的生物制剂。疫苗的制备方式多种多样,有利用病原微生物灭活后保留全微生物体做成的灭活疫苗,类毒素疫苗,利用病原微生物表面的有效抗原制备的亚单位疫苗,核酸疫苗(mRNA和DNA疫苗)以及载体疫苗等。对于载体疫苗,目前已开发出许多种类的载体,包括人造颗粒(金、聚合物、脂质胶束)和生物颗粒(核酸、蛋白质、病毒)。目前迅速发展的以外泌体作为疫苗载体具有许多优势。外泌体能够穿越血脑屏障,高效安全地运输,然后被目标细胞特异性识别。早在2000左右,研究者就报道了外泌体作为疫苗载体地第一个临床试验结果。到现在,许多基于外泌体载体的候选疫苗正在快速开发中,比如一些用于治疗癌症、艾滋病、乙肝和其他传染病等的疫苗。近年来,新冠疫情肆虐,针对COVID-19的疫苗开发重要且紧迫。目前,以外泌体为载体的新冠疫苗已有数十种处于临床研发状态( ClinicalTrials.gov)。例如,处于临床I期 (NCT04747574) 和临床II期(NCT04902183)的CD24疫苗;来源于骨髓间充质干细胞(bone marrow MSC)外泌体装载的疫苗(NCT04602442, NCT04276987,NCT04798716,NCT04491240);来源于T细胞外泌体装载的COVID-19疫苗(NCT04389385)等等。到目前为止,研究者针对外泌体装载疫苗已经有诸多关于其安全性和有效性的临床试验结果,而关于外泌体装载疫苗的具体给药剂量还需要更多的研究,以更好的诱导机体免疫原性或长期记忆反应,以到达预防新冠病毒的目的。
(Santos and Almeida, 2021)
综上,外泌体负载生物分子并在细胞间穿梭交流的特性,展现出高效特异呈递生物分子的潜力,逐渐发展成疾病治疗的一个重要手段。众多外泌体装载的治疗性药物和疫苗还处于临床试验阶段,拥有巨大的发展机遇,值得大力推进。
(Perocheau et al., 2021)
Alvarez-Erviti, L., Y. Seow, H. Yin, C. Betts, S. Lakhal and M. J. Wood (2011). "Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes." Nat Biotechnol 29(4): 341-345.
Aslan, C., S. H. Kiaie, N. M. Zolbanin, P. Lotfinejad, R. Ramezani, F. Kashanchi and R. Jafari (2021) "Exosomes for mRNA delivery: a novel biotherapeutic strategy with hurdles and hope." BMC biotechnology 21, 20 DOI: 10.1186/s12896-021-00683-w.
Forterre, A. V., J. H. Wang, A. Delcayre, K. Kim, C. Green, M. D. Pegram, S. S. Jeffrey and A. C. Matin (2020). "Extracellular Vesicle-Mediated In Vitro Transcribed mRNA Delivery for Treatment of HER2(+) Breast Cancer Xenografts in Mice by Prodrug CB1954 without General Toxicity." Mol Cancer Ther 19(3): 858-867.
Katakowski, M., B. Buller, X. Zheng, Y. Lu, T. Rogers, O. Osobamiro, W. Shu, F. Jiang and M. Chopp (2013). "Exosomes from marrow stromal cells expressing miR-146b inhibit glioma growth." Cancer Lett 335(1): 201-204.
Kojima, R., D. Bojar, G. Rizzi, G. C. Hamri, M. D. El-Baba, P. Saxena, S. Ausländer, K. R. Tan and M. Fussenegger (2018). "Designer exosomes produced by implanted cells intracerebrally deliver therapeutic cargo for Parkinson's disease treatment." Nat Commun 9(1): 1305.
Liu, Y., D. Li, Z. Liu, Y. Zhou, D. Chu, X. Li, X. Jiang, D. Hou, X. Chen, Y. Chen, Z. Yang, L. Jin, W. Jiang, C. Tian, G. Zhou, K. Zen, J. Zhang, Y. Zhang, J. Li and C. Y. Zhang (2015). "Targeted exosome-mediated delivery of opioid receptor Mu siRNA for the treatment of morphine relapse." Sci Rep 5: 17543.
Lu, M., H. Xing, Z. Xun, T. Yang, P. Ding, C. Cai, D. Wang and X. Zhao (2018). "Exosome-based small RNA delivery: Progress and prospects." Asian J Pharm Sci 13(1): 1-11.
Usman, W. M., T. C. Pham, Y. Y. Kwok, L. T. Vu, V. Ma, B. Peng, Y. S. Chan, L. Wei, S. M. Chin, A. Azad, A. B. He, A. Y. H. Leung, M. Yang, N. Shyh-Chang, W. C. Cho, J. Shi and M. T. N. Le (2018). "Efficient RNA drug delivery using red blood cell extracellular vesicles." Nat Commun 9(1): 2359.
Yang, Z., J. Shi, J. Xie, Y. Wang, J. Sun, T. Liu, Y. Zhao, X. Zhao, X. Wang, Y. Ma, V. Malkoc, C. Chiang, W. Deng, Y. Chen, Y. Fu, K. J. Kwak, Y. Fan, C. Kang, C. Yin, J. Rhee, P. Bertani, J. Otero, W. Lu, K. Yun, A. S. Lee, W. Jiang, L. Teng, B. Y. S. Kim and L. J. Lee (2020). "Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation." Nat Biomed Eng 4(1): 69-83.
Barile, L., and Vassalli, G. (2017). Exosomes: Therapy delivery tools and biomarkers of diseases. Pharmacology & Therapeutics 174, 63-78.
Hall, J., Prabhakar, S., Balaj, L., Lai, C.P., Cerione, R.A., and Breakefield, X.O. (2016). Delivery of Therapeutic Proteins via Extracellular Vesicles: Review and Potential Treatments for Parkinson's Disease, Glioma, and Schwannoma. Cell Mol Neurobiol 36, 417-427.
Kamerkar, S., LeBleu, V.S., Sugimoto, H., Yang, S., Ruivo, C.F., Melo, S.A., Lee, J.J., and Kalluri, R. (2017). Exosomes facilitate therapeutic targeting of oncogenic KRAS in pancreatic cancer. Nature 546, 498-503.
Mizrak, A., Bolukbasi, M.F., Ozdener, G.B., Brenner, G.J., Madlener, S., Erkan, E.P., Ströbel, T., Breakefield, X.O., and Saydam, O. (2013). Genetically engineered microvesicles carrying suicide mRNA/protein inhibit schwannoma tumor growth. Mol Ther 21, 101-108.
Ohno, S.-i., Takanashi, M., Sudo, K., Ueda, S., Ishikawa, A., Matsuyama, N., Fujita, K., Mizutani, T., Ohgi, T., Ochiya, T., et al. (2013). Systemically injected exosomes targeted to EGFR deliver antitumor microRNA to breast cancer cells. Mol Ther 21, 185-191.
Perocheau, D., Touramanidou, L., Gurung, S., Gissen, P., and Baruteau, J. (2021). Clinical applications for exosomes: Are we there yet? British Journal of Pharmacology 178, 2375-2392.
Santos, P., and Almeida, F. (2021). Exosome-Based Vaccines: History, Current State, and Clinical Trials. Front Immunol 12, 711565-711565.
Zhang, Y., Li, L., Yu, J., Zhu, D., Zhang, Y., Li, X., Gu, H., Zhang, C.Y., and Zen, K. (2014). Microvesicle-mediated delivery of transforming growth factor β1 siRNA for the suppression of tumor growth in mice. Biomaterials 35, 4390-4400.

