MSCs-Exo系列三 | 间充质干细胞外泌体在神经损伤中的应用
间充质干细胞(MSCs)是一种来自于中胚层的多能干细胞,具有高度的自我更 新及多向分化潜能,并在适宜的条件下具有诱导分化为肌细胞、软骨细胞、成骨细胞、成脂细胞 等多种细胞的能力。
MSCs 不仅具有多向分化潜能,而且还具有免疫调节功能,可抑制多种免 疫细胞的性能,调节免疫应答。
近年来,研究发现,来源于 MSCs 的外泌体(MSCs-Exo)具有与 MSCs 相似的组织损伤修复和再生功能。外泌体(exosome)是多种细胞分泌的膜外小囊泡,直径30~200nm,可以转运核酸、脂质和蛋白质,参与细胞间的信息交流。
与 MSCs 相比,外泌体用于临床疾病的治疗更加稳定,体内同种异体给药后免疫排斥反应的可能性较低,并可为各种 疾病提供替代疗法。MSCs-Exo 逐渐成为新的研究热点。
间充质干细胞外泌体的临床应用系列:
MSCs-Exo系列一 | 间充质干细胞外泌体在免疫调节中的作用
MSCs-Exo系列二 | 间充质干细胞外泌体在皮肤再生中的应用
MSCs-Exo系列三 | 间充质干细胞外泌体在神经损伤中的应用
MSCs-Exo系列四 | 间充质干细胞外泌体在肝损伤中的应用
MSCs-Exo系列五 | 间充质干细胞外泌体在肾损伤中的应用
MSCs-Exo系列六 | 间充质干细胞外泌体在脑卒中治疗中的应用
MSCs-Exo系列七 | 间充质干细胞外泌体在糖尿病治疗中的应用
本期:MSCs-Exo系列三 | 间充质干细胞外泌体在神经损伤中的应用
MSCs-Exo可以将许多遗传物质、神经营养因子和蛋白质传递到轴突,恢复微环境的稳态,调节轴突再生、促进神经形成和血管生成。
1.外泌体促进神经再生
德国汉诺威医学院的科研团队在Mol Neurobiol上发表了题为Effect of Exosomes from Rat Adipose-Derived Mesenchymal Stem Cells on Neurite Outgrowth and Sciatic Nerve Regeneration After Crush Injury(间充质干细胞外泌体对挤压伤后神经元生长和坐骨神经再生的影响)的研究报告。

该报告指出,周围神经损伤需要宏观环境和微观环境的最佳条件来促进轴突的再生。然而,大多数创伤性周围神经损伤的修复策略往往导致不满意的临床结果。
尽管已经采取了各种策略来改善宏观环境,但神经导管提供的微环境中轴突再生的基本分子机制仍不清楚。
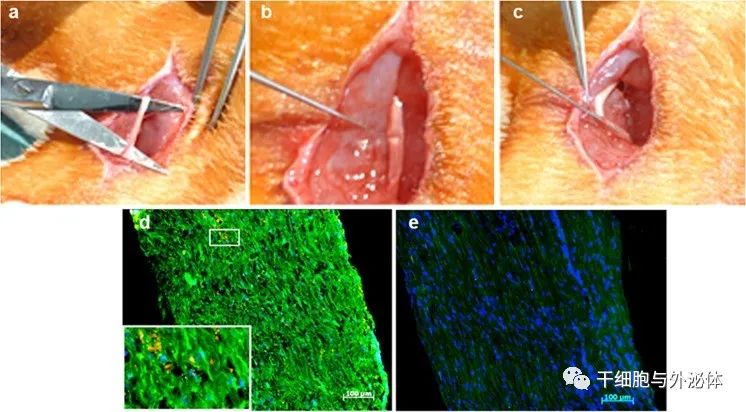
图:a, b 坐骨神经被处理后用细镊子压碎。c adMSC外泌体被注入近端和远端。再生的轴突用e S100和f神经丝(绿色)染色。PKH-26标记的adMSC外泌体(红色)。
在这项研究中,研究人员评估了源自脂肪间充质干细胞(adMSCs)的外泌体对坐骨神经再生和神经元生长的影响,并首次在adMSC外泌体中显示了神经生长因子转录物的存在。
研究结果表明,由adMSCs产生的外泌体参与了周围神经的再生,并有可能被用作有效的组织工程神经的治疗工具。
2.外泌体能够促进血管形成
研究发现来源于骨髓的MSCs-Exo具有支持血管形成作用,可抑制外周血单核细胞分泌 IFN-γ,内含有免疫相关 microRNA(miR-301、miR-22、miR-let-7a 等),能促进人脐静脉血管内皮细胞的血管和网状结构形成。
2019年天津医科大学总医院等科研团队在国际科技期刊Mol Cell Biochem.上发表了题为Proteomics analysis of Schwann cell-derived exosomes: a novel therapeutic strategy for central nervous system injury(外泌体的蛋白质组学分析:中枢神经系统损伤的新型治疗策略)的研究报告。

该报告指出,外泌体是参与细胞间交流的纳米大小的囊泡,它们由各种类型的细胞释放。
为了了解由雪旺细胞(SCs)产生的外泌体,并探索它们在修复中枢神经系统(CNS)方面的潜在功能,研究人员通过超速离心法从细胞的上清液中分离出外泌体,用电子显微镜和免疫印迹法对其进行表征,并利用蛋白质组学分析确定其蛋白质概况。
结果表明,雪旺细胞衍生的外泌体(SCDEs)平均直径为106.5纳米,呈圆形,有杯状凹陷,表达外泌体标记物CD9和Alix,但不表达肿瘤易感基因(TSG)101。
研究人员共鉴定了433个蛋白,其中398个蛋白与ExoCarta数据库重叠。根据它们的具体功能,确定了12个与中枢神经系统修复密切相关的蛋白质,并按不同的潜在机制进行分类,如轴突再生和炎症抑制。
基因肿瘤学分析表明,雪旺细胞衍生的外泌体主要参与了信号转导和细胞通讯。生物途径分析表明,途径大多参与外泌体的生物生成、形成、吸收和轴突再生。
在这些通路中,神经营养素、PI3K-Akt和cAMP信号通路在中枢神经系统修复中发挥了重要作用。
总之,该研究分离了雪旺细胞衍生的外泌体,揭示了它们的内容,提出了潜在的神经修复蛋白和途径,并提供了丰富的蛋白质组学数据资源,对今后研究单个蛋白在神经退行性疾病中的功能有重要价值。
3.外泌体能够促进中枢神经系统的神经发生
最近研究发现特定的 miRNAs (miR-23a、miR-200、miR-133b、miR-17-92 等)过表达可以促进神经基因和髓鞘化的形成,而在这过程 中主要是外泌体将 miRNAs 从神经元细胞体转移到轴突,从而介导轴突生长。
第三军医大学神经生物学重点实验室等科研团队在 J Neurosci Res.上发表了题为The role of the miR-17-92 cluster in neurogenesis and angiogenesis in the central nervous system of adults(miR-17-92在成人中枢神经系统的神经发生和血管生成中的作用)的研究报告。
该研究指出,神经生成并不是脑或脊髓损伤后功能完全恢复的唯一关注点,因为它已经阐明了血管生成在改善神经功能恢复方面的关键作用。
血管生成和神经生成在发育中和成年大脑中协调地相互作用,在此期间,它们可能对类似的介质和受体作出反应,其中它们有一个共同的转录后调节器:miR-17-92簇。miR-17-92簇最初被描述为一种肿瘤基因,后来被证明在发育和疾病期间分别驱动关键的生理和病理反应。
据报道,miR-17-92簇同时调节着神经发生和血管生成。miR-17-92簇调节神经祖细胞的增殖,不仅在发育过程中,而且在神经系统疾病如中风期间。
也有研究表明,内皮细胞的miR-17-92簇在胚胎阶段和成年期调节血管生成。
在这篇综述中,研究讨论了miR-17-92簇在神经元和血管可塑性中的作用,以及它作为中枢神经系统损伤的新型治疗策略的潜力。
4.外泌体促进外周神经细胞的再生
此外,有研究报道称牙龈来源的 MSCs-Exo 能够诱导分化(修复)表型相关基因的上调,从而促进外周神经细胞的再生。
研究还发现 PEDF 修饰的脂肪 MSCs-Exo 可以激活细胞自噬,抑制神经元细胞凋亡,从而改善脑损伤;
另外,近年来研究发现 MSCs- Exo 还可通过传递 miR-30d-5p 来抑制小胶质细胞的自噬,最终促进小胶质 细胞向抗炎表型的极化,从而逆转神经元的损伤,该研究不仅解释了 MSCs-Exo 介导神经炎症促进神经发生的机制,而 且还提示 MSCs-Exo 可能是一种很有前途的基因传递载体, 可以减轻神经炎症。
虽然目前许多实验证据表明,利用 MSCs-Exo 治疗周围神经损伤是有效和安全的,但这一领域还有待进一步研究,需要大量的工作来充分确定MSCs-Exo 在临床应用中的潜力。
本文转载自“ 干细胞与外泌体微信公众号”如有侵权请联系本站删除。

